Article original datant du 05/05/21

La pandémie de COVID-19 perturbe les vies dans le monde entier depuis plus d’un an. Le nombre de ses victimes atteindra bientôt trois millions de personnes. Pourtant, l’origine de la pandémie reste incertaine : Les intentions politiques des gouvernements et des scientifiques ont généré d’épais nuages d’obscurcissement, que la presse grand public semble impuissante à dissiper.
Dans ce qui suit, je ferai le tri parmi les faits scientifiques disponibles, qui recèlent de nombreux indices sur ce qui s’est passé, et je fournirai aux lecteurs les éléments nécessaires pour qu’ils puissent se faire leur propre opinion. J’essaierai ensuite d’évaluer la question complexe de la responsabilité, qui commence par le gouvernement chinois, mais va bien au-delà.
À la fin de cet article, vous aurez peut-être appris beaucoup de choses sur la biologie moléculaire des virus. Je vais essayer de rendre ce processus aussi indolore que possible. Mais la science ne peut être évitée car pour l’instant, et probablement pour longtemps encore, elle offre le seul fil conducteur sûr dans le labyrinthe.
Le virus à l’origine de la pandémie est connu officiellement sous le nom de SRAS-CoV-2, mais on peut l’appeler SRAS2 en abrégé. Comme beaucoup le savent, il existe deux grandes théories sur son origine. La première est qu’il est passé naturellement des animaux sauvages aux humains. L’autre est que le virus était à l’étude dans un laboratoire, d’où il s’est échappé. Il est très important de savoir laquelle des deux théories est la bonne si nous voulons éviter qu’un tel événement ne se reproduise.
Je décrirai les deux théories, j’expliquerai pourquoi chacune est plausible, puis je demanderai laquelle fournit la meilleure explication des faits disponibles. Il est important de noter que, jusqu’à présent, il n’existe aucune preuve directe de l’une ou l’autre théorie. Chacune dépend d’un ensemble de conjectures raisonnables, mais les preuves manquent. Je n’ai donc que des indices, et non des conclusions, à proposer. Mais ces indices pointent dans une direction spécifique. Et ayant déduit cette direction, je vais délimiter certains des fils de cet écheveau de désastre.
L’histoire de deux théories
Après l’apparition de la pandémie en décembre 2019, les autorités chinoises ont signalé que de nombreux cas étaient survenus sur le marché humide – un lieu de vente d’animaux sauvages pour la viande – de Wuhan. Cela a rappelé aux experts l’épidémie de SRAS1 de 2002, au cours de laquelle un virus de chauve-souris s’était d’abord propagé aux civettes, un animal vendu sur les marchés humides, puis des civettes aux humains. Un virus de chauve-souris similaire a provoqué une deuxième épidémie, connue sous le nom de MERS, en 2012. Cette fois, l’animal hôte intermédiaire était le chameau.
Le décodage du génome du virus a montré qu’il appartenait à une famille virale connue sous le nom de bêta-coronavirus, à laquelle appartiennent également les virus du SRAS1 et du MERS. Cette relation a conforté l’idée que, comme eux, il s’agissait d’un virus naturel qui avait réussi à passer des chauves-souris à l’homme en passant par un autre hôte animal. Le lien avec le marché humide, principal point de similitude avec les épidémies de SRAS1 et de MERS, a rapidement été rompu : les chercheurs chinois ont découvert des cas antérieurs à Wuhan, sans lien avec le marché aux puces. Mais cela ne semblait pas avoir d’importance alors que l’on attendait sous peu de nombreuses autres preuves en faveur de l’émergence naturelle.
Or, Wuhan abrite l’Institut de virologie de Wuhan, un centre mondial de premier plan pour la recherche sur les coronavirus. On ne pouvait donc pas exclure la possibilité que le virus du SRAS2 se soit échappé du laboratoire. Deux scénarios d’origine raisonnables étaient sur la table.
Dès le début, les perceptions du public et des médias ont été façonnées en faveur du scénario d’émergence naturelle par les déclarations fortes de deux groupes scientifiques. Ces déclarations n’ont dans un premier temps pas été examinées de manière aussi critique qu’elles auraient dû l’être.
« Nous nous unissons pour condamner fermement les théories de la conspiration suggérant que le COVID-19 n’a pas une origine naturelle », ont écrit un groupe de virologues et d’autres personnes dans le Lancet du 19 février 2020, alors qu’il était vraiment beaucoup trop tôt pour que quiconque soit sûr de ce qui s’était passé. Les scientifiques « concluent massivement que ce coronavirus provient de la faune sauvage », ont-ils déclaré, en lançant un vibrant appel de ralliement aux lecteurs pour qu’ils se tiennent aux côtés de leurs collègues chinois en première ligne de la lutte contre la maladie.
Contrairement à ce qu’affirment les auteurs de la lettre, l’idée que le virus ait pu s’échapper d’un laboratoire relève de l’accident et non de la conspiration. Elle aurait sûrement dû être explorée, et non rejetée d’emblée. Un signe distinctif des bons scientifiques est qu’ils se donnent beaucoup de mal pour faire la distinction entre ce qu’ils savent et ce qu’ils ne savent pas. Selon ce critère, les signataires de la lettre du Lancet se sont comportés comme de mauvais scientifiques : ils assuraient le public de faits dont ils ne pouvaient pas être certains de la véracité.
Il s’est avéré par la suite que la lettre du Lancet avait été organisée et rédigée par Peter Daszak, président de l’EcoHealth Alliance de New York. L’organisation de Daszak a financé des recherches sur les coronavirus à l’Institut de virologie de Wuhan. Si le virus du SRAS2 s’était effectivement échappé de recherches qu’il a financées, Daszak serait potentiellement coupable. Ce conflit d’intérêts aigu n’a pas été déclaré aux lecteurs du Lancet. Au contraire, la lettre concluait : « Nous ne déclarons aucun intérêt concurrent. »

Les virologues comme Daszak avaient beaucoup à perdre dans l’attribution de la responsabilité de la pandémie. Pendant 20 ans, la plupart du temps sans attirer l’attention du public, ils ont joué un jeu dangereux. Dans leurs laboratoires, ils créaient régulièrement des virus plus dangereux que ceux qui existent dans la nature. Ils ont fait valoir qu’ils pouvaient le faire en toute sécurité et qu’en devançant la nature, ils pouvaient prévoir et empêcher les « débordements » naturels, c’est-à-dire le passage des virus d’un hôte animal à l’homme. Si le SRAS2 s’était effectivement échappé d’une telle expérience de laboratoire, on pourrait s’attendre à un retour de flamme sauvage, et la tempête d’indignation publique toucherait les virologistes partout, et pas seulement en Chine. « Cela ferait voler en éclats l’édifice scientifique de haut en bas », a déclaré en mars 2020 un rédacteur de la MIT Technology Review, Antonio Regalado.
Une deuxième déclaration qui a eu une énorme influence sur l’attitude du public est une lettre (en d’autres termes, un texte d’opinion, et non un article scientifique) publiée le 17 mars 2020 dans la revue Nature Medicine. Ses auteurs étaient un groupe de virologues dirigé par Kristian G. Andersen du Scripps Research Institute. « Nos analyses montrent clairement que le SRAS-CoV-2 n’est pas une construction de laboratoire ou un virus manipulé à dessein », ont déclaré les cinq virologues dans le deuxième paragraphe de leur lettre.
Malheureusement, il s’agissait d’un autre cas de mauvaise science, au sens défini ci-dessus. Il est vrai que certaines anciennes méthodes de découpage et de collage de génomes viraux conservent des signes révélateurs de manipulation. Mais les méthodes plus récentes, appelées approches « no-see-um » (mouche microscopique, NdT) ou « seamless » (sans couture, NdT), ne laissent aucune marque déterminante. Il en va de même pour d’autres méthodes de manipulation des virus, comme le passage en série, c’est-à-dire le transfert répété de virus d’une culture de cellules à une autre. Si un virus a été manipulé, que ce soit par une méthode « sans couture » ou par un passage en série, il n’y a aucun moyen de savoir que c’est le cas. Andersen et ses collègues assuraient leurs lecteurs de quelque chose qu’ils ne pouvaient pas savoir.
La partie discussion de leur lettre commence ainsi : « Il est improbable que le SRAS-CoV-2 soit apparu par la manipulation en laboratoire d’un coronavirus apparenté au SRAS-CoV. » Mais attendez, le responsable n’a-t-il pas dit que le virus n’avait clairement pas été manipulé ? Le degré de certitude des auteurs semble avoir baissé de plusieurs crans lorsqu’il s’est agi d’exposer leur raisonnement.
La raison de ce glissement est claire une fois que l’on a pénétré dans le langage technique. Les deux raisons invoquées par les auteurs pour considérer la manipulation comme improbable sont décidément peu concluantes.
Premièrement, ils affirment que la protéine spike du SRAS2 se lie très bien à sa cible, le récepteur ACE2 humain, mais qu’elle le fait d’une manière différente de celle que les calculs physiques suggèrent comme étant la meilleure adaptation. Par conséquent, le virus doit être apparu par sélection naturelle, et non par manipulation.
Si cet argument semble difficile à saisir, c’est parce qu’il est très tendu. L’hypothèse de base des auteurs, non explicitée, est que quiconque tente de faire en sorte qu’un virus de chauve-souris se lie à des cellules humaines ne peut le faire que d’une seule manière. Il faudrait d’abord calculer l’ajustement le plus fort possible entre le récepteur ACE2 humain et la protéine spike avec laquelle le virus s’accroche à lui. Ils concevraient ensuite la protéine spike en conséquence (en sélectionnant la bonne chaîne d’unités d’acides aminés qui la composent). Selon l’article d’Andersen, la protéine spike du SRAS2 ne correspond pas à cette meilleure conception calculée et ne peut donc pas avoir été manipulée.
Mais cela ne tient pas compte de la manière dont les virologues obtiennent effectivement que les protéines spike se lient à des cibles choisies, non pas par calcul, mais en épissant des gènes de protéines spike provenant d’autres virus ou par passage en série. Dans le cas du passage en série, chaque fois que la progéniture du virus est transférée à de nouvelles cultures cellulaires ou à des animaux, les plus performants sont sélectionnés jusqu’à ce que l’un d’entre eux émerge et se lie très étroitement aux cellules humaines. La sélection naturelle a fait le plus gros du travail. Les spéculations de l’article d’Andersen sur la conception d’une protéine spike virale par le calcul n’ont aucune incidence sur le fait que le virus ait été manipulé ou non par l’une des deux autres méthodes.
Le deuxième argument des auteurs contre la manipulation est encore plus artificiel. Bien que la plupart des êtres vivants utilisent l’ADN comme matériel héréditaire, un certain nombre de virus utilisent l’ARN, le proche cousin chimique de l’ADN. Mais l’ARN étant difficile à manipuler, les chercheurs travaillant sur les coronavirus, qui sont basés sur l’ARN, commencent par convertir le génome ARN en ADN. Ils manipulent la version ADN, en ajoutant ou en modifiant des gènes, puis font en sorte que le génome ADN manipulé soit reconverti en ARN infectieux.
Seul un certain nombre de ces squelettes d’ADN ont été décrits dans la littérature scientifique. Toute personne manipulant le virus du SRAS2 aurait « probablement » utilisé l’un de ces squelettes connus, écrit le groupe Andersen, et puisque le SRAS2 n’est dérivé d’aucun d’entre eux, il n’a donc pas été manipulé. Mais l’argument est manifestement peu concluant. Les squelettes d’ADN sont assez faciles à fabriquer, il est donc évidemment possible que le SRAS2 ait été manipulé à l’aide d’un squelette d’ADN non publié.
Et c’est tout. Ce sont les deux arguments avancés par le groupe Andersen à l’appui de sa déclaration selon laquelle le virus du SRAS2 n’a manifestement pas été manipulé. Et cette conclusion, fondée sur rien d’autre que deux spéculations non concluantes, a convaincu la presse mondiale que le SRAS2 ne pouvait pas s’être échappé d’un laboratoire. Une critique technique de la lettre d’Andersen la prend en des termes plus durs.
La science est censée être une communauté d’experts qui s’autocorrigent et vérifient constamment le travail des autres. Alors pourquoi les autres virologues n’ont-ils pas fait remarquer que l’argument du groupe Andersen était plein de trous d’une taille absurde ? Peut-être parce que dans les universités d’aujourd’hui, la parole peut coûter très cher. Des carrières peuvent être détruites pour avoir dépassé les bornes. Tout virologue qui conteste l’opinion déclarée de la communauté risque de voir sa prochaine demande de subvention rejetée par le panel de collègues virologues qui conseille l’agence gouvernementale de distribution des subventions.
Les lettres de Daszak et d’Andersen étaient en fait des déclarations politiques et non scientifiques, mais elles ont été étonnamment efficaces. Les articles de la presse grand public ont répété à l’envi qu’un consensus d’experts avait écarté la possibilité d’une évasion du laboratoire ou qu’elle était extrêmement improbable. Leurs auteurs s’appuyaient pour la plupart sur les lettres de Daszak et Andersen, ne comprenant pas les lacunes béantes de leurs arguments. Les journaux grand public comptent tous des journalistes scientifiques dans leur équipe, tout comme les grandes chaînes de télévision, et ces reporters spécialisés sont censés pouvoir interroger les scientifiques et vérifier leurs affirmations. Mais les affirmations de Daszak et Andersen n’ont pas été contestées.
Doutes sur l’émergence naturelle
L’émergence naturelle était la théorie préférée des médias jusqu’aux environs de février 2021 et la visite d’une commission de l’Organisation Mondiale de la Santé (OMS) en Chine. La composition et l’accès de la commission étaient fortement contrôlés par les autorités chinoises. Ses membres, dont l’omniprésent Daszak, n’ont cessé d’affirmer avant, pendant et après leur visite que l’évasion du laboratoire était extrêmement improbable. Mais ce n’était pas tout à fait la victoire de propagande que les autorités chinoises espéraient peut-être. Ce qui est apparu clairement, c’est que les Chinois n’avaient aucune preuve à offrir à la commission à l’appui de la théorie de l’émergence naturelle.
Ce résultat était surprenant car les virus du SRAS1 et du MERS avaient tous deux laissé des traces importantes dans l’environnement. L’espèce hôte intermédiaire du SRAS1 a été identifiée dans les quatre mois suivant le déclenchement de l’épidémie, et l’hôte du MERS dans les neuf mois. Pourtant, quelque 15 mois après le début de la pandémie de SRAS2, et après des recherches vraisemblablement intensives, les chercheurs chinois n’avaient trouvé ni la population de chauves-souris d’origine, ni l’espèce intermédiaire à laquelle le SRAS2 aurait pu être transféré, ni aucune preuve sérologique qu’une quelconque population chinoise, y compris celle de Wuhan, ait jamais été exposée au virus avant décembre 2019. L’émergence naturelle restait une conjecture qui, bien que plausible au départ, n’avait pas obtenu la moindre preuve depuis plus d’un an.
Et tant que cela reste le cas, il est logique de s’intéresser sérieusement à l’autre hypothèse, selon laquelle le SRAS2 se serait échappé d’un laboratoire.
Pourquoi voudrait-on créer un nouveau virus capable de provoquer une pandémie ? Depuis que les virologues ont acquis les outils nécessaires pour manipuler les gènes d’un virus, ils ont fait valoir qu’ils pouvaient anticiper une pandémie potentielle en examinant dans quelle mesure un virus animal donné était susceptible de passer à l’homme. Et cela justifiait les expériences de laboratoire visant à renforcer la capacité des virus animaux dangereux à infecter l’homme, affirmaient les virologues.
Grâce à ce raisonnement, ils ont recréé le virus de la grippe de 1918, montré comment le virus de la polio, presque éteint, peut être synthétisé à partir de sa séquence d’ADN publiée, et introduit un gène de la variole dans un virus apparenté.
Ces améliorations des capacités virales sont connues sous le terme générique d’expériences de gain de fonction. Dans le cas des coronavirus, un intérêt particulier a été porté aux protéines spike, qui se dressent tout autour de la surface sphérique du virus et déterminent en grande partie l’espèce animale qu’il ciblera. En 2000, des chercheurs néerlandais ont ainsi gagné la gratitude des rongeurs du monde entier en modifiant génétiquement la protéine spike d’un coronavirus de souris pour qu’il ne s’attaque qu’aux chats.
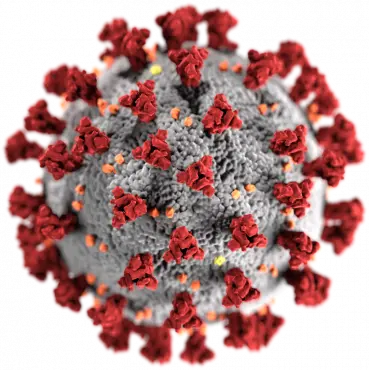
Les virologues ont commencé à étudier sérieusement les coronavirus de chauve-souris après que celles-ci se soient révélées être la source des épidémies de SRAS1 et de MERS. En particulier, les chercheurs ont voulu comprendre quelles modifications devaient être apportées aux protéines spike d’un virus de chauve-souris avant qu’il ne puisse infecter l’homme.
Les chercheurs de l’Institut de virologie de Wuhan, dirigés par le principal expert chinois des virus de chauves-souris, Shi Zheng-li ou « Bat Lady », ont organisé de fréquentes expéditions dans les grottes infestées de chauves-souris du Yunnan, dans le sud de la Chine, et ont collecté une centaine de coronavirus de chauves-souris différents.
Shi s’est ensuite associé à Ralph S. Baric, éminent chercheur sur les coronavirus à l’université de Caroline du Nord. Leurs travaux ont porté sur l’amélioration de la capacité des virus de chauve-souris à s’attaquer aux humains afin d' »examiner le potentiel d’émergence (c’est-à-dire la possibilité d’infecter les humains) des CoV [coronavirus] de chauve-souris en circulation. » Dans la poursuite de cet objectif, ils ont créé en novembre 2015 un nouveau virus en prenant le squelette du virus SARS1 et en remplaçant sa protéine spike par celle d’un virus de chauve-souris (connu sous le nom de SHC014-CoV). Ce virus fabriqué a été capable d’infecter les cellules des voies respiratoires humaines, du moins lorsqu’il a été testé contre une culture de laboratoire de ces cellules.
Le virus SHC014-CoV/SARS1 est connu sous le nom de chimère car son génome contient du matériel génétique provenant de deux souches de virus. Si le virus du SRAS2 avait été fabriqué dans le laboratoire de Shi, son prototype direct aurait été la chimère SHC014-CoV/SARS1, dont le danger potentiel a inquiété de nombreux observateurs et suscité d’intenses discussions.
« Si le virus s’échappait, personne ne pouvait prévoir sa trajectoire », a déclaré Simon Wain-Hobson, virologue à l’Institut Pasteur de Paris.
Baric et Shi ont mentionné les risques évidents dans leur article, mais ont fait valoir qu’ils devaient être mis en balance avec les avantages de la prévision des retombées futures. Les comités d’examen scientifique, écrivent-ils, « peuvent juger que des études similaires construisant des virus chimériques basés sur des souches en circulation sont trop risquées pour être poursuivies ». Compte tenu des diverses restrictions imposées à la recherche sur le gain de fonction (GOF), les choses en sont arrivées, selon eux, « à un carrefour de préoccupations concernant la recherche sur le GOF ; la possibilité de se préparer à de futures épidémies et de les atténuer doit être mise en balance avec le risque de créer des agents pathogènes plus dangereux. Dans l’élaboration des politiques à venir, il est important d’examiner la valeur des données générées par ces études et de déterminer si ces types d’études sur les virus chimériques justifient des recherches plus approfondies par rapport aux risques inhérents.
Cette déclaration a été faite en 2015. Avec le recul de 2021, on peut dire que la valeur des études de gain de fonction pour prévenir l’épidémie de SRAS2 était nulle. Le risque était catastrophique, si effectivement le virus du SRAS2 était généré dans une expérience de gain de fonction.
A l’intérieur de l’institut de virologie de Wuhan
Baric avait mis au point, et enseigné à Shi, une méthode générale permettant de modifier les coronavirus des chauves-souris pour qu’ils attaquent d’autres espèces. Les cibles spécifiques étaient les cellules humaines cultivées et les souris humanisées. Ces souris de laboratoire, qui constituent un substitut bon marché et éthique aux sujets humains, sont génétiquement modifiées pour porter la version humaine d’une protéine appelée ACE2 qui se trouve à la surface des cellules qui tapissent les voies respiratoires.
Shi est retournée dans son laboratoire à l’Institut de virologie de Wuhan et a repris le travail qu’elle avait commencé sur le génie génétique des coronavirus pour attaquer les cellules humaines. Comment pouvons-nous être aussi sûrs ?

En effet, par un étrange retournement de situation, ses travaux ont été financés par le National Institute of Allergy and Infectious Diseases (NIAID – Institut national des allergies et des maladies infectieuses ), qui fait partie des National Institutes of Health (NIH – Instituts nationaux de la santé) des États-Unis. Et les demandes de subventions qui ont financé ses travaux, qui sont du domaine public, précisent exactement ce qu’elle comptait faire avec l’argent.
Les subventions ont été attribuées à l’entrepreneur principal, Daszak de l’Alliance EcoHealth, qui les a sous-traitées à Shi. Voici des extraits des subventions pour les années fiscales 2018 et 2019. (« CoV » signifie coronavirus et « protéine S » fait référence à la protéine spike du virus).
« Tester les prédictions de transmission inter-espèces du CoV. Les modèles prédictifs de la gamme d’hôtes (c’est-à-dire le potentiel d’émergence) seront testés expérimentalement en utilisant la génétique inverse, les essais de liaison des pseudovirus et des récepteurs, et les expériences d’infection virale sur une gamme de cultures cellulaires de différentes espèces et de souris humanisées. ”
« Nous utiliserons les données de séquence de la protéine S, la technologie des clones contagieux, des expériences d’infection in vitro et in vivo et l’analyse de la liaison des récepteurs pour tester l’hypothèse selon laquelle les seuils de divergence en % dans les séquences de la protéine S permettent de prédire le potentiel de propagation. »
Ce que cela signifie, en langage non technique, c’est que Shi a entrepris de créer de nouveaux coronavirus présentant la plus grande contagiosité possible pour les cellules humaines. Son plan consistait à prendre des gènes qui « codent » pour des protéines spike possédant une variété d’affinités mesurées pour les cellules humaines, allant de fortes à faibles. Elle insèrerait ces gènes spike un par un dans le squelette d’un certain nombre de génomes viraux (« génétique inverse » et « technologie du clone contagieux »), créant ainsi une série de virus chimériques. Ces virus chimériques seraient ensuite testés pour leur capacité à attaquer des cultures de cellules humaines (« in vitro ») et des souris humanisées (« in vivo »). Ces informations permettraient de prédire la probabilité d’un « spillover », c’est-à-dire le passage d’un coronavirus de la chauve-souris à l’homme.
L’approche méthodique a été conçue pour trouver la meilleure combinaison de squelette de coronavirus et de protéine spike pour infecter des cellules humaines. Cette approche aurait pu générer des virus semblables à celui du SRAS2, et peut-être même créer le virus du SRAS2 lui-même avec la bonne combinaison de squelette viral et de protéine spike.
Il n’est pas encore possible d’affirmer que Shi a ou n’a pas généré le SRAS2 dans son laboratoire car ses dossiers ont été mis sous scellés, mais il semble qu’elle était certainement sur la bonne voie pour le faire. « Il est clair que l’Institut de virologie de Wuhan construisait systématiquement de nouveaux coronavirus chimériques et évaluait leur capacité à infecter des cellules humaines et des souris exprimant l’ACE2 humain », déclare Richard H. Ebright, biologiste moléculaire à l’université Rutgers et grand spécialiste de la biosécurité.
« Il est également clair », a déclaré Ebright, « qu’en fonction des contextes génomiques constants choisis pour l’analyse, ces travaux auraient pu produire le SRAS-CoV-2 ou un progéniteur proximal du SRAS-CoV-2 ». « Le contexte génomique » fait référence au squelette viral particulier utilisé comme banc d’essai pour la protéine spike.
Le scénario d’évasion du laboratoire concernant l’origine du virus du SRAS2, comme cela devrait maintenant être évident, n’est pas un simple signe de la main en direction de l’Institut de virologie de Wuhan. Il s’agit d’une proposition détaillée, basée sur le projet spécifique financé par le NIAID.
Même si la subvention exigeait le plan de travail décrit ci-dessus, comment pouvons-nous être sûrs que ce plan a bien été exécuté ? Pour cela, nous pouvons nous fier à la parole de M. Daszak, qui a beaucoup protesté ces 15 derniers mois en affirmant que l’évasion du laboratoire était une ridicule théorie du complot inventée par les China-bashers (« Détracteurs de Chine« ).
Le 9 décembre 2019, avant que le déclenchement de la pandémie ne soit connu de tous, Daszak a donné une interview dans laquelle il a parlé en termes élogieux de la façon dont les chercheurs de l’Institut de virologie de Wuhan avaient reprogrammé la protéine spike et généré des coronavirus chimériques capables d’infecter des souris humanisées.
« Et nous avons maintenant trouvé, vous savez, après 6 ou 7 ans de travail, plus de 100 nouveaux coronavirus liés au SRAS, très proches du SRAS », dit Daszak vers la 28e minute de l’interview. « Certains d’entre eux pénètrent dans les cellules humaines en laboratoire, d’autres peuvent provoquer la maladie du SRAS dans des modèles de souris humanisées et sont impossibles à traiter avec des monoclonaux thérapeutiques et vous ne pouvez pas vous vacciner contre eux avec un vaccin. Il s’agit donc d’un danger clair et présent… »
» Journaliste : Vous dites qu’il s’agit de divers coronavirus et que vous ne pouvez pas vous vacciner contre eux, et qu’il n’y a pas d’antiviraux – alors que faire ?
« Daszak : Eh bien je pense… les coronavirus – on peut les manipuler en laboratoire assez facilement. La protéine spike est à l’origine d’une grande partie de ce qui se passe avec les coronavirus, en matière de risque zoonotique. On peut donc obtenir la séquence, construire la protéine, et nous travaillons beaucoup avec Ralph Baric à l’UNC pour le faire. On l’insère dans le squelette d’un autre virus et on travaille en laboratoire. Donc, vous pouvez mieux anticiper le résultat lorsque vous trouvez une séquence. Vous avez cette diversité. Maintenant, la progression logique pour les vaccins est la suivante : si vous devez développer un vaccin contre le SRAS, les gens vont utiliser le SRAS pandémique, mais insérons certains de ces autres éléments pour obtenir un meilleur vaccin. » Les insertions auxquelles il fait référence comprennent peut-être un élément appelé site de clivage de la furine, discuté ci-dessous, qui augmente considérablement la contagiosité virale pour les cellules humaines.
Dans un style décousu, M. Daszak fait référence au fait qu’une fois que vous avez généré un nouveau coronavirus capable d’attaquer les cellules humaines, vous pouvez prendre la protéine spike et en faire la base d’un vaccin.
On ne peut qu’imaginer la réaction de Daszak lorsqu’il a appris le déclenchement de l’épidémie à Wuhan quelques jours plus tard. Il connait mieux que quiconque l’objectif de l’Institut de Wuhan de rendre les coronavirus des chauves-souris contagieux pour l’homme, ainsi que les faiblesses de la défense de l’Institut contre l’contamination de ses propres chercheurs.
Mais au lieu de fournir aux autorités sanitaires les nombreuses informations dont il disposait, il a immédiatement lancé une campagne de relations publiques pour persuader le monde que l’épidémie ne pouvait pas être causée par l’un des virus améliorés de l’institut. « L’idée que ce virus s’est échappé d’un laboratoire est une pure connerie. C’est tout simplement faux », a-t-il déclaré lors d’une interview en avril 2020.
Les mesures de sécurité à l’Institut de virologie de Wuhan
M. Daszak n’était peut-être pas au courant, ou peut-être ne connaissait-il que trop bien, la longue histoire des virus qui s’échappent des laboratoires, même les mieux gérés. Le virus de la variole s’est échappé trois fois de laboratoires en Angleterre dans les années 1960 et 1970, provoquant 80 cas et 3 décès. Depuis, des virus dangereux se sont échappés de laboratoires presque chaque année. Plus récemment, le virus du SRAS1 s’est révélé un véritable artiste de l’évasion, s’échappant de laboratoires de Singapour, de Taïwan et pas moins de quatre fois de l’Institut national chinois de virologie à Pékin.
L’une des raisons pour lesquelles le SRAS1 a été si difficile à gérer est qu’il n’existait pas de vaccins pour protéger le personnel de laboratoire. Comme l’a mentionné M. Daszak dans l’interview du 19 décembre citée ci-dessus, les chercheurs de Wuhan n’avaient pas non plus été en mesure de mettre au point des vaccins contre les coronavirus qu’ils avaient conçus pour infecter les cellules humaines. Ils auraient été aussi démunis contre le virus du SRAS2, s’il avait été généré dans leur laboratoire, que leurs collègues de Pékin l’étaient contre le SRAS1.
Une deuxième raison expliquant le grave danger que représentent les nouveaux coronavirus est liée aux niveaux de sécurité requis dans les laboratoires. Il existe quatre niveaux de sécurité, appelés BSL1 à BSL4, le BSL4 étant le plus restrictif et conçu pour les agents pathogènes mortels comme le virus Ebola.
L’Institut de virologie de Wuhan disposait d’un nouveau laboratoire BSL4, mais son état de préparation a considérablement alarmé les inspecteurs du département d’État qui l’ont visité depuis l’ambassade de Pékin en 2018. « Le nouveau laboratoire souffre d’une grave pénurie de techniciens et d’enquêteurs convenablement formés, nécessaires pour faire fonctionner en toute sécurité ce laboratoire à haut niveau de confinement », ont écrit les inspecteurs dans un câble du 19 janvier 2018.
Le vrai problème, cependant, n’était pas l’insécurité du laboratoire BSL4 de Wuhan, mais le fait que les virologues du monde entier n’aiment pas travailler dans des conditions BSL4. Il faut porter une combinaison spatiale, effectuer des opérations dans des armoires fermées et accepter que tout prenne deux fois plus de temps. Les règles assignant à chaque type de virus un niveau de sécurité donné étaient donc plus laxistes que ce que d’aucuns pourraient penser être prudent.
Avant 2020, les règles suivies par les virologues en Chine et ailleurs exigeaient que les expériences avec les virus du SRAS1 et du MERS soient menées dans des conditions de sécurité biologique de niveau 3. Mais tous les autres coronavirus de chauve-souris pouvaient être étudiés en BSL2, le niveau immédiatement inférieur. Le niveau de sécurité BSL2 exige que l’on prenne des précautions de sécurité assez minimes, comme le port de blouses et de gants de laboratoire, l’interdiction d’aspirer des liquides avec une pipette et l’installation de panneaux d’avertissement de danger biologique. Pourtant, une expérience de gain de fonction menée en BSL2 pourrait produire un agent plus infectieux que le SRAS1 ou le MERS. Et si c’était le cas, les travailleurs de laboratoire auraient de fortes chances d’être contaminés, surtout s’ils ne sont pas vaccinés.
La plupart des travaux de Shi sur le gain de fonction dans les coronavirus ont été réalisés au niveau de sécurité BSL2, comme l’indiquent ses publications et d’autres documents. Elle a déclaré dans une interview au magazine Science que « [les] recherches sur les coronavirus dans notre laboratoire sont menées dans des laboratoires de niveau de sécurité BSL-2 ou BSL-3 ».
« Il est clair qu’une partie ou la totalité de ces travaux ont été effectués selon une norme de biosécurité – niveau de biosécurité 2, soit le niveau de biosécurité d’un cabinet dentaire américain standard – qui présente un risque élevé inacceptable d’infection du personnel de laboratoire au contact d’un virus ayant les propriétés de transmission du SRAS-CoV-2 », déclare Ebright.
« Il est également clair », ajoute-t-il, « que ce travail n’aurait jamais dû être financé et n’aurait jamais dû être effectué ».
C’est un point de vue qu’il défend, que le virus du SRAS2 soit ou non entré dans un laboratoire.
Les inquiétudes concernant les conditions de sécurité au laboratoire de Wuhan n’étaient, semble-t-il, pas hors de propos. Selon une fiche d’information publiée par le département d’État le 21 janvier 2021, « le gouvernement américain a des raisons de croire que plusieurs chercheurs à l’intérieur du WIV sont tombés malades à l’automne 2019, avant le premier cas identifié de l’épidémie, avec des symptômes correspondant à la fois au COVID-19 et à des maladies saisonnières communes. »
David Asher, membre de l’Institut Hudson et ancien consultant du département d’État, a fourni plus de détails sur l’incident lors d’un séminaire. La connaissance de l’incident provenait d’un mélange d’informations publiques et « d’informations de haut niveau recueillies par notre communauté du renseignement », a-t-il déclaré. Trois personnes travaillant dans un laboratoire BSL3 de l’institut sont tombées malades à une semaine d’intervalle, avec des symptômes graves qui ont nécessité une hospitalisation. Il s’agit du « premier groupe connu, à notre connaissance, de victimes de ce que nous pensons être le COVID-19 ». La grippe n’a pas pu être complètement exclue, mais elle semblait peu probable dans ces circonstances, a-t-il ajouté.
Comparaison des scénarios rivaux sur l’origine du SRAS2
Les éléments ci-dessus constituent une preuve sérieuse que le virus du SRAS2 pourrait avoir été créé dans un laboratoire, d’où il aurait ensuite fuité. Mais l’affaire, aussi solide soit-elle, n’est pas une preuve. La preuve consisterait à prouver, à l’Institut de virologie de Wuhan ou dans des laboratoires connexes de Wuhan, que le SRAS2 ou un virus prédécesseur y était en cours de développement. Faute d’accès à de tels documents, une autre approche consiste à prendre certains faits prépondérants concernant le virus du SRAS2 et à se demander dans quelle mesure chacun d’entre eux est expliqué par les deux scénarios d’origine rivales, à savoir l’émergence naturelle et l’évasion du laboratoire. Voici quatre tests des deux hypothèses. Quelques-uns comportent des détails techniques, mais ceux-ci sont parmi les plus convaincants pour ceux qui souhaitent suivre l’argumentation.
1) Le lieu d’origine. Commencez par la géographie. Les deux plus proches parents connus du virus du SRAS2 ont été prélevés sur des chauves-souris vivant dans des grottes du Yunnan, une province du sud de la Chine. Si le virus du SRAS2 avait d’abord infecté les personnes vivant autour des grottes du Yunnan, cela confirmerait fortement l’idée que le virus s’est transmis naturellement à l’homme. Mais ce n’est pas ce qui s’est passé. La pandémie s’est déclarée à 1 500 kilomètres de là, à Wuhan.
Les bêta-coronavirus, la famille des virus de chauve-souris à laquelle appartient le SRAS2, infectent la chauve-souris Rhinolophus affinis, dont l’aire de répartition s’étend dans le sud de la Chine. Le rayon d’action des chauves-souris étant de 50 kilomètres, il est peu probable qu’elles soient parvenues jusqu’à Wuhan. Quoi qu’il en soit, les premiers cas de la pandémie de COVID-19 sont probablement apparus en septembre, lorsque les températures dans la province de Hubei sont déjà suffisamment froides pour que les chauves-souris entrent en hibernation.
Et si les virus des chauves-souris avaient d’abord contaminé un hôte intermédiaire ? Il faudrait une population de chauves-souris vivant depuis longtemps à proximité d’un hôte intermédiaire, qui à son tour doit souvent croiser des personnes. Tous ces échanges de virus doivent avoir lieu quelque part en dehors de Wuhan, une métropole très fréquentée qui, pour autant que l’on sache, n’est pas un habitat naturel des colonies de chauves-souris Rhinolophus. La personne (ou l’animal) contaminée, porteuse de ce virus hautement transmissible, a dû se rendre à Wuhan sans infecter personne d’autre. Aucun membre de sa famille n’a été malade. Si la personne a pris le train pour Wuhan, aucun autre passager n’est tombé malade.
En d’autres termes, il est difficile de faire en sorte que la pandémie se déclare naturellement en dehors de Wuhan puis, sans laisser de traces, y fasse sa première apparition.
Pour le scénario de fuite du laboratoire, l’origine de Wuhan pour le virus est une évidence. Wuhan abrite le principal centre de recherche sur les coronavirus en Chine où, comme nous l’avons vu plus haut, les chercheurs modifiaient génétiquement les coronavirus de chauve-souris pour qu’ils attaquent les cellules humaines. Ils le faisaient dans les conditions de sécurité minimales d’un laboratoire BSL2. Si un virus ayant le pouvoir contaminant inattendu du SRAS2 avait été généré dans ce laboratoire, sa fuite n’aurait rien de surprenant.
2) Histoire naturelle et évolution. La localisation initiale de la pandémie n’est qu’une petite partie d’un problème plus vaste, celui de son histoire naturelle. Les virus ne font pas que des sauts uniques d’une espèce à une autre. La protéine spike du coronavirus, adaptée à l’attaque des cellules de chauve-souris, doit faire des sauts répétés vers une autre espèce, dont la plupart échouent, avant d’obtenir une mutation chanceuse. La mutation – un changement dans l’une de ses unités d’ARN – entraîne l’incorporation d’une unité d’acide aminé différente dans sa protéine spike et rend cette dernière plus apte à attaquer les cellules d’une autre espèce.
Par le biais de plusieurs autres ajustements de ce type dus à des mutations, le virus s’adapte à son nouvel hôte, par exemple un animal avec lequel les chauves-souris sont en contact fréquent. L’ensemble du processus reprend ensuite lorsque le virus passe de cet hôte intermédiaire à l’homme.
Dans le cas du SRAS1, les chercheurs ont documenté les modifications successives de sa protéine spike au fur et à mesure de l’évolution du virus vers un pathogène dangereux. Après que le virus soit passé des chauves-souris aux civettes, six autres modifications ont été apportées à sa protéine spike avant qu’il ne devienne un pathogène bénin pour l’homme. Après 14 autres modifications, le virus s’est beaucoup mieux adapté à l’homme, et quatre autres modifications ont permis à l’épidémie de prendre son envol.
Mais lorsqu’on cherche les empreintes d’une transition similaire dans le SRAS2, une étrange surprise nous attend. Le virus n’a pratiquement pas mutéé, du moins jusqu’à récemment. Dès sa première apparition, il était bien adapté aux cellules humaines. Les chercheurs dirigés par Alina Chan du Broad Institute ont comparé le SRAS2 avec le SRAS1 au stade tardif, qui était alors bien adapté aux cellules humaines, et ont constaté que les deux virus étaient pareillement bien adaptés. « Au moment où le SRAS-CoV-2 a été détecté pour la première fois fin 2019, il était déjà pré-adapté à la transmission humaine dans une mesure similaire à celle du SRAS-CoV épidémique tardif », ont-ils écrit.
Même ceux qui pensent qu’une origine de laboratoire est peu probable s’accordent à dire que les génomes du SRAS2 sont remarquablement uniformes. Baric écrit que « les premières souches identifiées à Wuhan, en Chine, présentaient une diversité génétique limitée, ce qui suggère que le virus a pu être introduit à partir d’une source unique. »
Une source unique serait bien sûr compatible avec l’évasion en laboratoire, mais moins avec la variation et la sélection massives qui sont la marque de fabrique de l’évolution.
La structure uniforme des génomes du SRAS2 ne laisse entrevoir aucun passage par un hôte animal intermédiaire, et aucun hôte de ce type n’a été identifié dans la nature.
Les partisans de l’émergence naturelle suggèrent que le SRAS2 a incubé dans une population humaine non encore trouvée avant d’acquérir ses propriétés particulières. Ou qu’il est passé à un animal hôte en dehors de la Chine.
Toutes ces conjectures sont possibles, mais tendues. Les partisans d’une fuite de laboratoire ont une explication plus simple. Le SRAS2 était adapté aux cellules humaines dès le départ, car il a été cultivé sur des souris humanisées ou dans des cultures de laboratoire de cellules humaines, comme décrit dans la proposition de subvention de Daszak. Son génome présente une faible diversité, car la caractéristique des cultures de laboratoire est l’uniformité.
Les partisans de l’évasion en laboratoire plaisantent en disant que le virus du SRAS2 a bien sûr infecté une espèce hôte intermédiaire avant de se propager à l’homme, et qu’ils l’ont identifiée – une souris humanisée de l’Institut de virologie de Wuhan.
3) Le site de clivage de la furine. Le site de clivage de la furine est une partie minuscule de l’anatomie du virus, mais qui exerce une grande influence sur sa contagiosité. Il se trouve au milieu de la protéine de pointe du SRAS2. Il est également au cœur de l’énigme de l’origine du virus.
La protéine spike comporte deux sous-unités ayant des rôles différents. La première, appelée S1, reconnaît la cible du virus, une protéine appelée enzyme de conversion de l’angiotensine-2 (ou ACE2) qui se trouve à la surface des cellules qui tapissent les voies respiratoires humaines. La seconde, S2, aide le virus, une fois ancré à la cellule, à fusionner avec la membrane cellulaire. Une fois que la membrane externe du virus a fusionné avec celle de la cellule touchée, le génome viral est injecté dans la cellule, détourne son mécanisme de fabrication de protéines et l’oblige à générer de nouveaux virus.
Mais cette invasion ne peut pas commencer tant que les sous-unités S1 et S2 n’ont pas été séparées. Et là, juste à la jonction S1/S2, se trouve le site de clivage de la furine qui garantit que la protéine de pointe sera clivée exactement au bon endroit.
Le virus, un modèle de conception économique, ne porte pas son propre clivage. Il compte sur la cellule pour faire le clivage à sa place. Les cellules humaines possèdent à leur surface un outil de coupe protéique appelé furine. La furine coupe toute chaîne de protéines qui porte son site de coupe cible caractéristique. Il s’agit de la séquence d’unités d’acides aminés proline-arginine-arginine-alanine, ou ERAR dans le code qui désigne chaque acide aminé par une lettre de l’alphabet. L’ERAR est la séquence d’acides aminés au cœur du site de clivage de la furine du SRAS2.
Les virus ont toutes sortes d’astuces, alors pourquoi le site de clivage de la furine se distingue-t-il ? Parmi tous les bêta-coronavirus connus liés au SRAS, seul SARS2 possède un site de clivage de la furine. Pour tous les autres virus, l’unité S2 est clivée à un autre endroit et par un autre mécanisme.
Comment le SRAS2 a-t-il donc acquis son site de clivage de la furine ? Soit le site a évolué naturellement, soit il a été inséré par les chercheurs à la jonction S1/S2 dans une expérience de gain de fonction.
Considérons d’abord l’origine naturelle. Les virus évoluent de deux manières : par mutation et par recombinaison. La mutation est le processus de changement aléatoire de l’ADN (ou de l’ARN pour les coronavirus) qui se traduit généralement par l’échange d’un acide aminé contre un autre dans une chaîne protéique. Un grand nombre de ces modifications nuisent au virus, mais la sélection naturelle retient les quelques unes qui sont utiles. La mutation est le processus par lequel la protéine de pointe du SRAS1 a progressivement changé ses cellules cibles préférées, passant de celles des chauves-souris à celles des civettes, puis à celles des humains.
La mutation semble être un moyen moins probable de générer le site de clivage de la furine du SRAS2, même si elle ne peut être totalement exclue. Les quatre unités d’acides aminés du site sont toutes réunies, et toutes situées au bon endroit dans la jonction S1/S2. La mutation est un processus aléatoire déclenché par des erreurs de copie (lorsque de nouveaux génomes viraux sont générés) ou par la désintégration chimique des unités génomiques. Elle affecte donc généralement des acides aminés uniques à différents endroits d’une chaîne de protéines. Une chaîne d’acides aminés comme celle du site de clivage de la furine a beaucoup plus de chances d’être acquise dans son ensemble par un processus tout à fait différent appelé recombinaison.
La recombinaison est un échange involontaire de matériel génomique qui se produit lorsque deux virus envahissent la même cellule et que leur progéniture est assemblée avec des morceaux d’ARN appartenant à l’autre. Les bêta-coronavirus ne se combinent qu’avec d’autres bêta-coronavirus mais peuvent acquérir, par recombinaison, presque tous les éléments génétiques présents dans le pool génomique collectif. Ce qu’ils ne peuvent pas acquérir, c’est un élément que le pool ne possède pas. Et aucun bêta-coronavirus connu lié au SRAS, la classe à laquelle appartient le SRAS2, ne possède de site de clivage de la furine.
Les partisans de l’émergence naturelle affirment que le SRAS2 pourrait avoir récupéré ce site auprès d’un bêta-coronavirus encore inconnu. Mais les bêta-coronavirus liés au SRAS n’ont manifestement pas besoin d’un site de clivage de la furine pour infecter les cellules de chauve-souris. Il est donc peu probable que l’un d’entre eux en possède un, et aucun n’a été découvert jusqu’à présent.
L’argument suivant des promoteurs est que le SRAS2 a acquis son site de clivage de la furine à partir de l’homme. Un prédécesseur du SRAS2 aurait pu circuler dans la population humaine pendant des mois ou des années jusqu’à ce qu’il obtienne un site de clivage de la furine à partir de cellules humaines. Il aurait alors été prêt à se manifester sous forme de pandémie.
Si c’est ce qui s’est passé, il devrait y avoir des traces dans les dossiers de surveillance des hôpitaux des personnes contaminées par le virus qui évolue lentement. Mais aucune n’a été mise en évidence jusqu’à présent. Selon le rapport de l’OMS sur les origines du virus, les hôpitaux sentinelles de la province du Hubei, où se trouve Wuhan, surveillent régulièrement les maladies de type grippal et « aucun élément ne permet de penser qu’il y a eu une transmission substantielle du SARSCoV-2 dans les mois précédant la flambée de décembre ».
Il est donc difficile d’expliquer comment le virus du SRAS2 a obtenu son site de clivage de la furine de manière naturelle, que ce soit par mutation ou par recombinaison.
Il reste donc une expérience de gain de fonction. Pour ceux qui pensent que le SRAS2 s’est échappé d’un laboratoire, expliquer le site de clivage de la furine n’est pas un problème du tout. « Depuis 1992, la communauté virologique sait que le seul moyen sûr de rendre un virus plus mortel est de lui donner un site de clivage de la furine à la jonction S1/S2 en laboratoire », écrit Steven Quay, un entrepreneur en biotechnologie qui s’intéresse aux origines du SRAS2. « Au moins 11 expériences de gain de fonction, consistant à ajouter un site de furine pour rendre un virus plus infectieux, sont publiées dans la littérature ouverte, notamment [par] le Dr Zhengli Shi, responsable de la recherche sur les coronavirus à l’Institut de virologie de Wuhan. »
4) Une question de codons. Il y a un autre aspect du site de clivage de la furine qui réduit encore plus la possibilité d’une origine d’émergence naturelle.
Comme tout le monde le sait (ou peut au moins s’en souvenir depuis le lycée), le code génétique utilise trois unités d’ADN pour spécifier chaque unité d’acide aminé d’une chaîne de protéines. Lorsqu’ils sont lus par groupes de 3, les 4 différents types d’ADN peuvent spécifier 4 x 4 x 4 ou 64 triplets différents, ou codons comme on les appelle. Comme il n’existe que 20 types d’acides aminés, il y a plus qu’assez de codons pour tous, ce qui permet à certains acides aminés d’être spécifiés par plus d’un codon. L’acide aminé arginine, par exemple, peut être désigné par l’un des six codons CGU, CGC, CGA, CGG, AGA ou AGG, où A, U, G et C représentent les quatre différents types d’unités de l’ARN.
C’est là que ça devient intéressant. Des organismes différents ont des préférences différentes en matière de codons. Les cellules humaines aiment désigner l’arginine par les codons CGT, CGC ou CGG. Mais CGG est le codon le moins populaire du coronavirus pour l’arginine. Gardez cela à l’esprit lorsque vous examinez comment les acides aminés du site de clivage de la furine sont codés dans le génome du SRAS2.
La raison fonctionnelle pour laquelle le SRAS2 possède un site de clivage de la furine, alors que ses virus cousins n’en ont pas, peut être observée en alignant (dans un ordinateur) la chaîne de près de 30 000 nucléotides de son génome avec celle de ses coronavirus cousins, dont le plus proche connu à ce jour est le RaTG13. Par rapport au RaTG13, le SRAS2 présente un insert de 12 nucléotides juste à la jonction S1/S2. L’insert est la séquence T-CCT-CGG-CGG-GC. Le CCT code pour la proline, les deux CGG pour deux arginines, et le GC est le début d’un codon GCA qui code pour l’alanine.
Cet insert présente plusieurs caractéristiques curieuses, mais la plus étrange est celle des deux codons CGG côte à côte. Seuls 5 % des codons arginine du SRAS2 sont CGG, et le double codon CGG-CGG n’a été trouvé dans aucun autre bêta-coronavirus. Comment le SRAS2 a-t-il donc acquis une paire de codons arginine qui sont favorisés par les cellules humaines mais pas par les coronavirus ?
Les partisans de l’émergence naturelle n’ont pas la tâche facile pour expliquer toutes les caractéristiques du site de clivage de la furine du SRAS2. Ils doivent postuler un événement de recombinaison à un endroit du génome du virus où les recombinaisons sont rares, et l’insertion d’une séquence de 12 nucléotides avec un double codon arginine inconnu dans le répertoire des bêta-coronavirus, au seul endroit du génome qui augmenterait de manière significative la contagiosité du virus.
« Oui, mais votre formulation rend cela improbable – les virus sont des spécialistes des événements inhabituels », riposte David L. Robertson, virologue à l’Université de Glasgow, qui considère le fuite de laboratoire comme une théorie du complot. « La recombinaison est naturellement très, très fréquente dans ces virus, il y a des points d’arrêt de recombinaison dans la protéine spike et ces codons semblent inhabituels exactement parce que nous n’avons pas suffisamment échantillonné. »
Robertson a raison de dire que l’évolution produit toujours des résultats qui peuvent sembler improbables mais qui, en fait, ne le sont pas. Les virus peuvent générer un nombre incalculable de variants, mais nous ne voyons que le variant sur un milliard que la sélection naturelle choisit pour sa survie. Mais cet argument peut être poussé trop loin. Par exemple, tout résultat d’une expérience de gain de fonction pourrait être expliqué comme un résultat auquel l’évolution serait parvenue à temps. Et le jeu des chiffres peut être joué dans l’autre sens. Pour que le site de clivage de la furine apparaisse naturellement dans le SRAS2, une chaîne d’événements doit se produire, chacun d’entre eux étant assez improbable pour les raisons évoquées ci-dessus. Une longue chaîne comportant plusieurs étapes improbables a peu de chances de se terminer un jour.
Pour le scénario de fuite de laboratoire, le double codon CGG n’est pas une surprise. Le codon préféré des humains est couramment utilisé dans les laboratoires. Ainsi, toute personne souhaitant insérer un site de clivage de la furine dans le génome du virus synthétiserait la séquence de fabrication de l’ERAR en laboratoire et serait susceptible d’utiliser des codons CGG pour le faire.
« Lorsque j’ai vu pour la première fois le site de clivage de la furine dans la séquence virale, avec ses codons arginine, j’ai dit à ma femme que c’était la preuve irréfutable de l’origine du virus », a déclaré David Baltimore, éminent virologue et ancien président de CalTech. « Ces caractéristiques remettent fortement en question l’idée d’une origine naturelle du SRAS2 », a-t-il ajouté. [1]
Un troisième scénario d’origine
Il existe une variante du scénario de l’émergence naturelle qui mérite d’être examinée. Il s’agit de l’idée que le SRAS2 est passé directement des chauves-souris à l’homme, sans passer par un hôte intermédiaire comme l’ont fait le SRAS1 et le MERS. L’un de ses principaux défenseurs est le virologue David Robertson, qui note que le SRAS2 peut s’attaquer à plusieurs autres espèces que l’homme. Il pense que le virus a acquis une capacité généraliste lorsqu’il était encore dans les chauves-souris. Les chauves-souris qu’il contamine étant largement répandues dans le sud et le centre de la Chine, le virus a eu amplement l’occasion de passer à l’homme, même s’il ne semble l’avoir fait qu’à une seule occasion connue. La thèse de Robertson explique pourquoi personne n’a jusqu’à présent trouvé de trace du SRAS2 chez un hôte intermédiaire ou dans les populations humaines surveillées avant décembre 2019. Elle expliquerait également le fait déroutant que le SARS2 n’a pas muté depuis sa première apparition chez l’homme – il n’en avait pas besoin car il pouvait déjà attaquer efficacement les cellules humaines.
Cette idée pose toutefois un problème : si le SRAS2 est passé des chauves-souris à l’homme en un seul bond et n’a pas beaucoup muté depuis, il devrait toujours être capable d’contaminer les chauves-souris. Et il semble que ce ne soit pas le cas.
« Les espèces de chauves-souris testées sont faiblement contaminées par le SRAS-CoV-2 et il est donc peu probable qu’elles soient la source directe de l’infection humaine », écrit un groupe de scientifiques sceptiques quant à l’émergence naturelle.
Pourtant, Robertson a peut-être mis le doigt sur quelque chose. Les coronavirus des chauves-souris des grottes du Yunnan peuvent infecter directement les gens. En avril 2012, six mineurs nettoyant le guano de chauve-souris de la mine de Mojiang ont contracté une pneumonie sévère avec des symptômes semblables à ceux du COVID-19 et trois sont finalement morts. Un virus isolé de la mine de Mojiang, appelé RaTG13, est toujours le plus proche parent connu du SRAS2. Beaucoup de mystère entoure l’origine, la déclaration et l’affinité étrangement faible de RaTG13 pour les cellules de chauve-souris, ainsi que la nature de 8 virus similaires que Shi rapporte avoir collectés au même moment mais qui n’ont pas encore été publiés malgré leur grande pertinence pour l’ascendance du SRAS2. Mais tout cela est une histoire pour une autre fois. Ce qu’il faut retenir, c’est que les virus de chauve-souris peuvent contaminer directement l’homme, mais seulement dans des conditions particulières.
En dehors des mineurs qui extraient le guano des chauves-souris, qui entre donc en contact particulièrement étroit avec les coronavirus des chauves-souris ? Eh bien, les chercheurs en coronavirus. Shi affirme qu’elle et son groupe ont collecté plus de 1 300 échantillons de chauves-souris au cours de quelque huit visites de la grotte de Mojiang entre 2012 et 2015, et il y a sans doute eu de nombreuses expéditions dans d’autres grottes du Yunnan.
Imaginez que les chercheurs fassent de fréquents allers-retours entre Wuhan et le Yunnan, remuant le guano de chauve-souris dans des grottes et des mines sombres, et vous commencez à voir un lien manquant possible entre les deux endroits. Les chercheurs ont pu être contaminés au cours de leurs voyages de collecte, ou en travaillant avec les nouveaux virus à l’Institut de technologie de Wuhan. Le virus qui s’est échappé du laboratoire aurait été un virus naturel, et non un virus inventé par gain de fonction.
La thèse du lien direct avec des chauves-souris est une chimère entre les scénarios de l’émergence naturelle et de l’évasion en laboratoire. C’est une possibilité que l’on ne peut écarter. Mais elle est contrecarrée par les faits suivants : 1) le SARS2 et le RaTG13 semblent avoir une faible affinité pour les cellules de chauve-souris, de sorte que l’on ne peut pas être totalement sûr que l’un ou l’autre ait jamais vu l’intérieur d’une chauve-souris ; et 2) la théorie n’est pas meilleure que le scénario de l’émergence naturelle pour expliquer comment le SARS2 a obtenu son site de clivage de la furine, ou pourquoi le site de clivage de la furine est déterminé par les codons d’arginine préférés par l’homme au lieu des codons préférés par la chauve-souris.
Où nous en sommes jusqu’à présent ?
Ni l’hypothèse de l’émergence naturelle ni celle de la fuite de laboratoire ne peuvent encore être écartées. Il n’y a toujours pas de preuve directe pour l’une ou l’autre. On ne peut donc pas tirer de conclusion définitive.
Cela dit, les preuves disponibles penchent plus fortement dans un sens que dans l’autre. Les lecteurs se feront leur propre opinion. Mais il me semble que les partisans de la fuite de laboratoire peuvent expliquer tous les faits disponibles concernant le SRAS2 beaucoup plus facilement que les partisans de l’émergence naturelle.
Il est établi que les chercheurs de l’Institut de virologie de Wuhan ont réalisé des expériences de gain de fonction visant à faire en sorte que les coronavirus infectent des cellules humaines et des souris humanisées. C’est exactement le type d’expérience à partir duquel un virus semblable au SRAS2 aurait pu émerger. Les chercheurs n’étaient pas vaccinés contre les virus étudiés et ils travaillaient dans les conditions de sécurité minimales d’un laboratoire BSL2. La fuite d’un virus ne serait donc pas du tout surprenante. Dans toute la Chine, la pandémie a éclaté aux portes de l’institut de Wuhan. Le virus était déjà bien adapté aux humains, comme prévu pour un virus cultivé sur des souris humanisées. Il possédait une amélioration inhabituelle, un site de clivage de la furine, qu’aucun autre bêta-coronavirus connu lié au SRAS ne possède, et ce site comprenait un double codon arginine également inconnu chez les bêta-coronavirus. Quelle autre preuve pourrait-on souhaiter, à part les dossiers de laboratoire actuellement introuvables qui documentent la création du SARS2 ?
Les partisans de l’émergence naturelle ont une histoire un peu plus difficile à raconter. La plausibilité de leur cause repose sur une seule hypothèse, le parallèle attendu entre l’émergence du SRAS2 et celle du SRAS1 et du MERS. Mais aucune des preuves attendues à l’appui d’une telle histoire parallèle n’est encore apparue. Personne n’a trouvé la population de chauves-souris qui a été la source du SRAS2, si tant est qu’elle ait jamais infecté des chauves-souris. Aucun hôte intermédiaire ne s’est présenté, malgré les recherches intensives menées par les autorités chinoises, qui ont notamment permis de tester 80 000 animaux. Rien ne prouve que le virus ait effectué de multiples sauts indépendants de son hôte intermédiaire vers l’homme, comme l’ont fait les virus du SRAS1 et du MERS. Rien dans les registres de surveillance des hôpitaux n’indique que l’épidémie ait pris de l’ampleur dans la population à mesure que le virus évoluait. Rien ne permet d’expliquer pourquoi une épidémie naturelle s’est déclarée à Wuhan et nulle part ailleurs. Rien ne permet d’expliquer comment le virus a acquis son site de clivage de la furine, qu’aucun autre bêta-coronavirus lié au SRAS ne possède, ni pourquoi ce site est composé de codons préférés par l’homme. La théorie de l’émergence naturelle se heurte à un ensemble hérissé d’invraisemblances.
Les archives de l’Institut de virologie de Wuhan contiennent certainement de nombreuses informations pertinentes. Mais les autorités chinoises semblent peu enclines à les divulguer, car il y a de fortes chances qu’elles incriminent le régime dans la création de la pandémie. En l’absence des efforts d’un courageux dénonciateur chinois, nous avons peut-être déjà à portée de main à peu près toutes les informations pertinentes que nous sommes susceptibles d’obtenir avant longtemps.
Il vaut donc la peine d’essayer d’évaluer la responsabilité de la pandémie, au moins de manière provisoire, car l’objectif primordial reste d’en empêcher une autre. Même ceux qui ne sont pas persuadés que la fuite de laboratoire est l’origine la plus probable du virus du SRAS2 peuvent voir des raisons de s’inquiéter de l’état actuel de la réglementation régissant la recherche par gain de fonction. Il y a deux niveaux de responsabilité évidents : le premier, pour avoir permis aux virologues de réaliser des expériences de type « gain de fonction », offrant un gain minimal et un risque énorme ; le second, si le SRAS2 a effectivement été généré dans un laboratoire, pour avoir permis au virus de s’échapper et de déclencher une pandémie mondiale. Voici les acteurs qui semblent les plus susceptibles de mériter un blâme.
1. Les virologues chinois. Avant tout, les virologues chinois sont à blâmer pour avoir réalisé des expériences de gain de fonction dans des conditions de sécurité de niveau BSL2, bien trop laxistes pour contenir un virus d’une contagiosité inattendue comme le SRAS2. Si le virus s’est effectivement échappé de leur laboratoire, ils méritent le blâme du monde entier pour un accident prévisible qui a déjà causé la mort de trois millions de personnes. Certes, Shi a été formée par des virologues français, a travaillé en étroite collaboration avec des virologues américains et suivait les règles internationales de confinement des coronavirus. Mais elle aurait pu et dû faire sa propre évaluation des risques qu’elle courait. Elle et ses collègues portent la responsabilité de leurs actes.
J’ai utilisé l’Institut de Virologie de Wuhan comme raccourci pour toutes les activités virologiques de Wuhan. Il est possible que le SRAS2 ait été créé dans un autre laboratoire de Wuhan, peut-être dans le but de fabriquer un vaccin efficace contre tous les coronavirus. Mais jusqu’à ce que le rôle des autres virologues chinois soit clarifié, Shi est le visage public des travaux chinois sur les coronavirus, et provisoirement, elle et ses collègues seront les premiers à subir l’opprobre.
2. Les autorités chinoises. Les autorités centrales chinoises n’ont pas généré le SRAS2, mais elles ont certainement fait tout leur possible pour dissimuler la nature de la tragédie et la responsabilité de la Chine dans celle-ci. Elles ont supprimé tous les dossiers de l’Institut de Virologie de Wuhan et fermé ses bases de données virales. Ils ont publié un filet d’informations, dont la plupart étaient peut-être carrément fausses ou conçues pour détourner l’attention et induire en erreur. Ils ont fait de leur mieux pour manipuler l’enquête de l’OMS sur les origines du virus, et ont entraîné les membres de la commission dans un tourbillon infructueux. Jusqu’à présent, ils se sont montrés bien plus intéressés à détourner les responsabilités qu’à prendre les mesures nécessaires pour prévenir une seconde pandémie.
3. La communauté mondiale des virologues. Les virologues du monde entier forment une communauté professionnelle très soudée. Ils écrivent des articles dans les mêmes revues. Ils participent aux mêmes conférences. Ils ont des intérêts communs dans la recherche de fonds auprès des gouvernements et dans le fait de ne pas être surchargés par les règlements de sécurité.
Les virologues connaissaient mieux que quiconque les dangers de la recherche par gain de fonction. Mais le pouvoir de créer de nouveaux virus, et le financement de la recherche qu’ils pouvaient ainsi obtenir, étaient trop tentants. Ils ont poursuivi les expériences de gain de fonction. Ils ont fait pression contre le moratoire imposé sur le financement fédéral de la recherche par gain de fonction en 2014, et il a été levé en 2017.
Les avantages de la recherche en matière de prévention des épidémies futures ont été jusqu’à présent nuls, et les risques énormes. Si la recherche sur les virus du SRAS1 et du MERS ne pouvait se faire qu’au niveau de sécurité BSL3, il était sûrement illogique d’autoriser tout travail sur les nouveaux coronavirus au niveau inférieur de BSL2. Que le SRAS2 se soit échappé ou non d’un laboratoire, les virologues du monde entier ont joué avec le feu.
Leur comportement a longtemps alarmé d’autres biologistes. En 2014, des scientifiques se faisant appeler le Cambridge Working Group ont appelé à la prudence concernant la création de nouveaux virus. Dans des termes prémonitoires, ils ont précisé le risque de créer un virus semblable au SRAS2. « Les risques d’accident avec les « agents pathogènes pandémiques potentiels » nouvellement créés soulèvent de nouvelles préoccupations graves », ont-ils écrit. « La création en laboratoire de nouvelles souches hautement transmissibles de virus dangereux, en particulier mais pas seulement de la grippe, présente des risques considérablement accrus. Une contamination accidentelle dans un tel cadre pourrait déclencher des épidémies qu’il serait difficile, voire impossible, de contrôler. »
Lorsque les biologistes moléculaires ont découvert une technique permettant de déplacer des gènes d’un organisme à l’autre, ils ont organisé une conférence publique à Asilomar en 1975 pour discuter des risques possibles. Malgré une forte opposition interne, ils ont dressé une liste de mesures de sécurité strictes qui pourraient être assouplies à l’avenir – et qui l’ont été – lorsque les risques possibles auront été mieux évalués.
Lorsque la technique CRISPR d’édition des gènes a été inventée, des biologistes ont rédigé un rapport conjoint des académies nationales des sciences des États-Unis, du Royaume-Uni et de la Chine pour inciter à la modération dans la modification du génome humain. Les biologistes qui ont inventé les manipulations génétiques ont également été ouverts aux dangers de leur travail et ont cherché à impliquer le public.
On pourrait penser que la pandémie de SRAS2 inciterait les virologues à réévaluer les avantages de la recherche sur les gains de fonction, voire à associer le public à leurs délibérations. Mais non. De nombreux virologues tournent en dérision la fuite de laboratoire comme une théorie de la conspiration, et d’autres ne disent rien. Ils se sont barricadés derrière une muraille de silence qui, jusqu’à présent, fonctionne bien pour apaiser, ou du moins retarder, la curiosité des journalistes et la colère du public. Les professions qui ne peuvent pas s’autoréguler méritent d’être réglementées par d’autres, et il semble que ce soit l’avenir que les virologues sont en train de choisir pour eux-mêmes.
4. Le rôle des États-Unis dans le financement de l’Institut de Virologie de Wuhan. De juin 2014 à mai 2019, l’EcoHealth Alliance de M. Daszak a bénéficié d’une subvention du National Institute of Allergy and Infectious Diseases (NIAID), qui fait partie des National Institutes of Health, pour effectuer des recherches sur le gain de fonction avec des coronavirus au Wuhan Institute of Virology. Que le SRAS2 soit ou non le produit de cette recherche, il semble que la politique consistant à confier des recherches à haut risque à des laboratoires étrangers peu sûrs et utilisant des précautions de sécurité minimales soit discutable. Et si le virus du SRAS2 s’est effectivement échappé de l’institut de Wuhan, le NIH se retrouvera dans la terrible position d’avoir financé une expérience désastreuse qui a entraîné la mort de plus de 3 millions de personnes dans le monde, dont plus d’un demi-million de ses propres citoyens.
La responsabilité du NIAID et du NIH est d’autant plus lourde que pendant les trois premières années de la subvention accordée à EcoHealth Alliance, il existait un moratoire sur le financement de la recherche sur les gains de fonction. Pourquoi les deux agences n’ont-elles pas mis fin au financement fédéral, comme la loi les y obligeait apparemment ? Parce que quelqu’un a écrit une faille dans le moratoire.
Le moratoire interdisait spécifiquement le financement de toute recherche à gain de fonction qui augmenterait la pathogénicité des virus de la grippe, du MERS ou du SRAS. Mais une note de bas de page à la page 2 du document sur le moratoire indique qu' » une exception à la pause de recherche peut être obtenue si le responsable de l’agence de financement du gouvernement des États-Unis détermine que la recherche est nécessaire de toute urgence pour protéger la santé publique ou la sécurité nationale. «
Cela semble signifier que le directeur du NIAID, Anthony Fauci, ou le directeur du NIH, Francis Collins, ou peut-être les deux, auraient invoqué la note de bas de page afin de maintenir le financement de la recherche sur les gains de fonction de Shi.
Malheureusement, le directeur du NIAID et le directeur des NIH ont exploité cette faille pour accorder des exemptions aux projets soumis à la Pause – en affirmant de façon grotesque que la recherche exemptée était « nécessaire de toute urgence pour protéger la santé publique ou la sécurité nationale » – annulant ainsi la Pause », a déclaré Ebright dans une interview accordée à Independent Science News.
Lorsque le moratoire a pris fin en 2017, il n’a pas simplement disparu, mais a été remplacé par un système de déclaration, le cadre de contrôle et de surveillance des agents pathogènes pandémiques potentiels (P3CO), qui obligeait les agences à signaler pour examen tout travail dangereux à gain de fonction qu’elles souhaitaient financer.
Selon Ebright, Collins et Fauci « ont refusé de signaler et de transmettre les propositions pour un examen des risques et des avantages, annulant ainsi le cadre de P3CO ».
Selon lui, les deux fonctionnaires, en s’occupant du moratoire et du système de rapports qui en découle, « ont systématiquement contrecarré les efforts déployés par la Maison Blanche, le Congrès, les scientifiques et les spécialistes de la politique scientifique pour réglementer les recherches préoccupantes de type GoF [gain-of-function] ».
Il est possible que les deux responsables aient dû tenir compte de questions qui ne sont pas évidentes dans les dossiers publics, comme les questions de sécurité nationale. Le financement de l’Institut de virologie de Wuhan, dont on pense qu’il a des liens avec des virologues militaires chinois, a peut-être ouvert une fenêtre sur la recherche chinoise en matière de guerre biologique. Mais quelles que soient les autres considérations en jeu, l’essentiel est que les National Institutes of Health ont soutenu la recherche sur le gain de fonction, d’un type qui aurait pu générer le virus du SRAS2, dans un laboratoire étranger non supervisé qui travaillait dans des conditions de biosécurité BSL2. La prudence de cette décision peut être mise en doute, que le SRAS2 et la mort de 3 millions de personnes en soient la conséquence ou non, ce qui souligne la nécessité d’un meilleur système de contrôle.
En conclusion
Si la preuve que le SRAS2 a été créé dans un laboratoire est si solide, pourquoi n’est-elle pas plus largement connue ? Comme on peut le constater maintenant, de nombreuses personnes ont des raisons de ne pas en parler. La liste est menée, bien sûr, par les autorités chinoises. Mais les virologues des États-Unis et d’Europe n’ont pas grand intérêt à déclencher un débat public sur les expériences de gain de fonction que leur communauté mène depuis des années.
D’autres scientifiques ne se sont pas non plus manifestés pour soulever la question. Les fonds de recherche gouvernementaux sont distribués sur l’avis de comités d’experts scientifiques issus des universités. Quiconque fait des vagues en soulevant des questions politiques gênantes court le risque que sa subvention ne soit pas renouvelée et que sa carrière de chercheur prenne fin. La bonne conduite est peut-être récompensée par les nombreux avantages qui émaillent le système de distribution. Et si vous pensiez qu’Andersen et Daszak avaient peut-être entaché leur réputation d’objectivité scientifique après leurs attaques partisanes contre le scénario de fuite de laboratoire, regardez les deuxième et troisième noms de cette liste de bénéficiaires d’une subvention de 82 millions de dollars annoncée par l’Institut national des allergies et des maladies infectieuses en août 2020.
Le gouvernement américain partage un étrange intérêt commun avec les autorités chinoises : ni l’un ni l’autre ne tient à attirer l’attention sur le fait que les travaux de Shi sur le coronavirus ont été financés par les National Institutes of Health américains. On peut imaginer la conversation en coulisses au cours de laquelle le gouvernement chinois dira : « Si cette recherche était si dangereuse, pourquoi l’avez-vous financée, et en plus sur notre territoire ? » Ce à quoi la partie américaine pourrait répondre : « On dirait que c’est vous qui l’avez laissé s’échapper. Mais avons-nous vraiment besoin d’avoir cette discussion en public ? »
Fauci est un fonctionnaire de longue date qui a servi avec intégrité sous le président Trump et a repris le leadership de l’administration Biden dans la gestion de l’épidémie de COVID-19. Le Congrès, sans doute de manière compréhensible, peut avoir peu d’appétit pour le traîner sur les charbons ardents pour l’apparente faute de jugement dans le financement de la recherche sur le gain de fonction à Wuhan.
À ces murs de silence s’ajoute celui des médias grand public. À ma connaissance, aucun grand journal ou réseau de télévision n’a encore fourni à ses lecteurs un reportage approfondi sur le scénario d’évasion du laboratoire, comme celui que vous venez de lire, bien que certains aient publié de brefs éditoriaux ou des articles d’opinion. On pourrait penser que toute origine plausible d’un virus qui a tué trois millions de personnes mériterait une enquête sérieuse. Ou que le bien-fondé de la poursuite de la recherche sur le gain de fonction, quelle que soit l’origine du virus, mériterait d’être examiné. Ou encore, le financement de la recherche sur les gains de fonction par les NIH et le NIAID pendant un moratoire sur ce type de recherche mériterait une enquête. Comment expliquer le manque apparent de curiosité des médias ?
L’omertà des virologues en est une raison. Les journalistes scientifiques, contrairement aux journalistes politiques, ont peu de scepticisme inné à l’égard des motivations de leurs sources ; la plupart d’entre eux considèrent que leur rôle consiste essentiellement à transmettre la sagesse des scientifiques aux masses non averties. Ainsi, lorsque leurs sources refusent de les aider, ces journalistes sont désemparés.
Une autre raison, peut-être, est la migration d’une grande partie des médias vers la gauche du spectre politique. Parce que le président Trump a déclaré que le virus s’était échappé d’un laboratoire de Wuhan, les rédacteurs en chef ont accordé peu de crédit à cette idée. Ils ont rejoint les virologistes en considérant la fuite de laboratoire comme une théorie de conspiration discutable. Sous l’administration Trump, ils n’ont eu aucun mal à rejeter la position des services de renseignement selon laquelle la fuite de laboratoire ne pouvait être exclue. Mais lorsqu’Avril Haines, la directrice du renseignement national du président Biden, a dit la même chose, elle a elle aussi été largement ignorée. Il ne s’agit pas de dire que les rédacteurs auraient dû approuver le scénario de fuite de laboratoire, mais simplement qu’ils auraient dû explorer cette possibilité de manière complète et équitable.
Les personnes du monde entier qui ont été pratiquement confinées chez elles l’année dernière aimeraient peut-être avoir une meilleure réponse que celle que leur donnent les médias. Peut-être qu’une réponse émergera avec le temps. Après tout, plus les mois passent sans que la théorie de l’émergence naturelle ne reçoive la moindre preuve, moins elle semble plausible. Peut-être la communauté internationale des virologues finira-t-elle par être considérée comme un guide faux et intéressé. La perception de bon sens selon laquelle une pandémie qui se déclare à Wuhan pourrait avoir quelque chose à voir avec un laboratoire de Wuhan qui fabrique de nouveaux virus présentant un danger maximal dans des conditions dangereuses pourrait finalement supplanter l’insistance idéologique selon laquelle tout ce que Trump a dit ne peut pas être vrai.
Et ensuite, que les comptes commencent.
Notes
(1) Cette citation a été ajoutée à l’article après sa publication initiale.
Remerciements
La première personne à se pencher sérieusement sur les origines du virus du SRAS2 a été Yuri Deigin, un entrepreneur en biotechnologie en Russie et au Canada. Dans un long et brillant essai, il a disséqué la biologie moléculaire du virus du SRAS2 et a évoqué, sans l’approuver, la possibilité qu’il ait été manipulé. Cet essai, publié le 22 avril 2020, a fourni une feuille de route à tous ceux qui cherchent à comprendre les origines du virus. Deigin a rassemblé tant d’informations et d’analyses dans son essai que certains ont douté qu’il puisse être l’œuvre d’un seul individu et ont suggéré qu’une agence de renseignement devait en être l’auteur. Mais l’essai est écrit avec plus de légèreté et d’humour que les rapports de la CIA ou du KGB, et je ne vois aucune raison de douter que Deigin en soit l’auteur unique et très compétent.
Dans le sillage de Deigin, plusieurs autres sceptiques de l’orthodoxie des virologues ont suivi. Nikolai Petrovsky a calculé l’intensité avec laquelle le virus du SRAS2 se lie aux récepteurs ACE2 de diverses espèces et a constaté, à sa grande surprise, qu’il semblait optimisé pour le récepteur humain, ce qui l’a amené à penser que le virus avait pu être généré en laboratoire. Alina Chan a publié un article montrant que le SRAS2, dès sa première apparition, était très bien adapté aux cellules humaines.
L’un des rares scientifiques de l’establishment à avoir remis en question le rejet absolu de l’évasion en laboratoire par les virologues est Richard Ebright, qui met en garde depuis longtemps contre les dangers de la recherche par gain de fonction. Un autre est David A. Relman, de l’université de Stanford. « Même si les opinions tranchées abondent, aucun de ces scénarios ne peut être exclu avec certitude sur la base des faits actuellement disponibles », a-t-il écrit. Bravo également à Robert Redfield, ancien directeur des Centers for Disease Control and Prevention, qui a déclaré à CNN le 26 mars 2021 que la cause « la plus probable » de l’épidémie provenait « d’un laboratoire », car il doutait qu’un virus de chauve-souris puisse devenir un pathogène humain extrême du jour au lendemain, sans prendre le temps d’évoluer, comme cela semblait être le cas avec le SRAS2.
Steven Quay, un médecin-chercheur, a appliqué des outils statistiques et bioinformatiques à des explorations ingénieuses de l’origine du virus, montrant par exemple comment les hôpitaux recevant les premiers patients sont regroupés le long de la ligne de métro №2 de Wuhan, qui relie l’Institut de virologie à l’aéroport international, la courroie de transmission parfaite pour distribuer le virus du laboratoire au monde entier.
En juin 2020, Milton Leitenberg a publié une étude préliminaire des preuves en faveur de l’évasion des laboratoires de la recherche sur le gain de fonction à l’Institut de virologie de Wuhan.
Beaucoup d’autres ont apporté des pièces importantes du puzzle. « La vérité est la fille, disait Francis Bacon, non pas de l’autorité mais du temps. » C’est grâce aux efforts de personnes telles que celles citées ci-dessus qu’il en est ainsi.





